Методы исследований в дизайне - Клинические исследования : классификация, дизайн, оценка эффекта
Дизайны клинических испытаний
Адаптивный дизайн - это дизайн клинического исследования, который позволяет адаптировать, модифицировать необходимые аспекты дизайна исследования после его инициации и запуска без потери значимости, целостности, адекватности и обоснованности исследованиЯ 1. Примерами адаптивного дизайна являются последовательный анализ group sequential design , дизайн с возможностью перерасчета размера выборки sample - size reestimation design , дизайн исключения худших групп drop - loser design ; существуют адаптивные дизайны, которые используют данные, полученные с помощью биомаркеров; дизайн для поиска дозы, классический для ранних фаз, также может быть отнесен к подвиду адаптивного дизайна 2. Некоторые адаптивные конструкции позволяют изменять рандомизационную последовательность в исследовании, дозировку исследуемого препарата, менять исследуемые группы местами, изменять гипотезы 3.



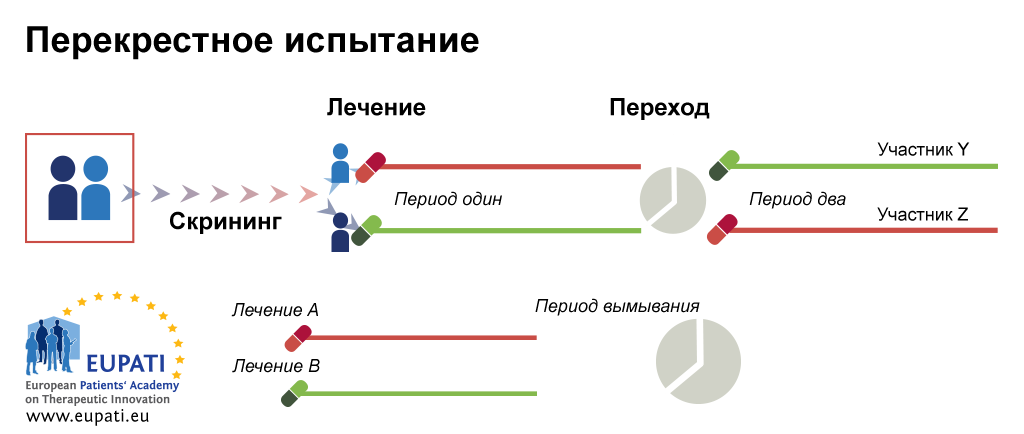






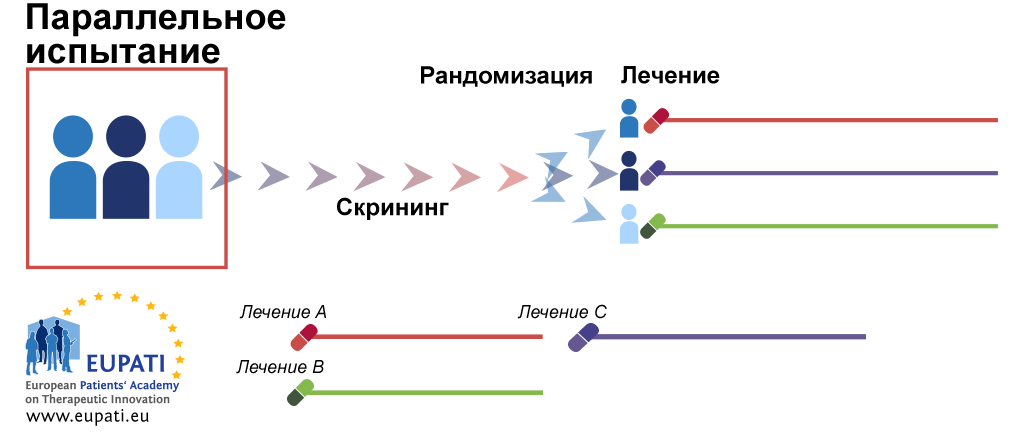
При адаптивном дизайне клинического исследования параметры и проведение исследования потенциального лекарственного препарата или вакцины могут подвергаться изменениям на основе промежуточного анализа [1] , [2] , [3]. Адаптивный дизайн исследования включает расширенный статистический анализ для интерпретации конечной точки клинического исследования [2]. Это контрастирует с традиционными одногрупповыми то есть нерандомизированными клиническими исследованиями или рандомизированными клиническими исследованиями РКИ , протоколы которых являются статичными и параметры которых не изменяются до завершения исследования. Процесс адаптации происходит на определенных этапах исследования, прописанных в его протоколе. Важно отметить, что протокол исследования устанавливается до его начала с указанием графика адаптации и процессов. PANDA англ.
- Составляющие клинических исследований и терминология
- Категория: Медицина.
- Дизайн клинических исследований испытаний выстраивается перед написанием подробного протокола исследования в зависимости от его ключевой цели.
- Должны ли клинические рекомендации быть обязательными для исполнения?
- Планирование клинического исследования – с чего начать?
- Ассоциация организаций по клиническим исследованиям AOKИ — некоммерческая организация, объединяющая юридических лиц, участников российского рынка клинических исследований. Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря г.
- Такие исследования проводятся в соответствии с основополагающими этическими принципами Хельсинкской Декларации, Правилами GCP Good Clinical Practice , Надлежащая Клиническая Практика и действующими нормативными требованиями.
- Клинические исследования лекарственного средства являются необходимым этапом разработки любого нового препарата, или расширения показаний для применения лекарственного средства, уже известного врачам.








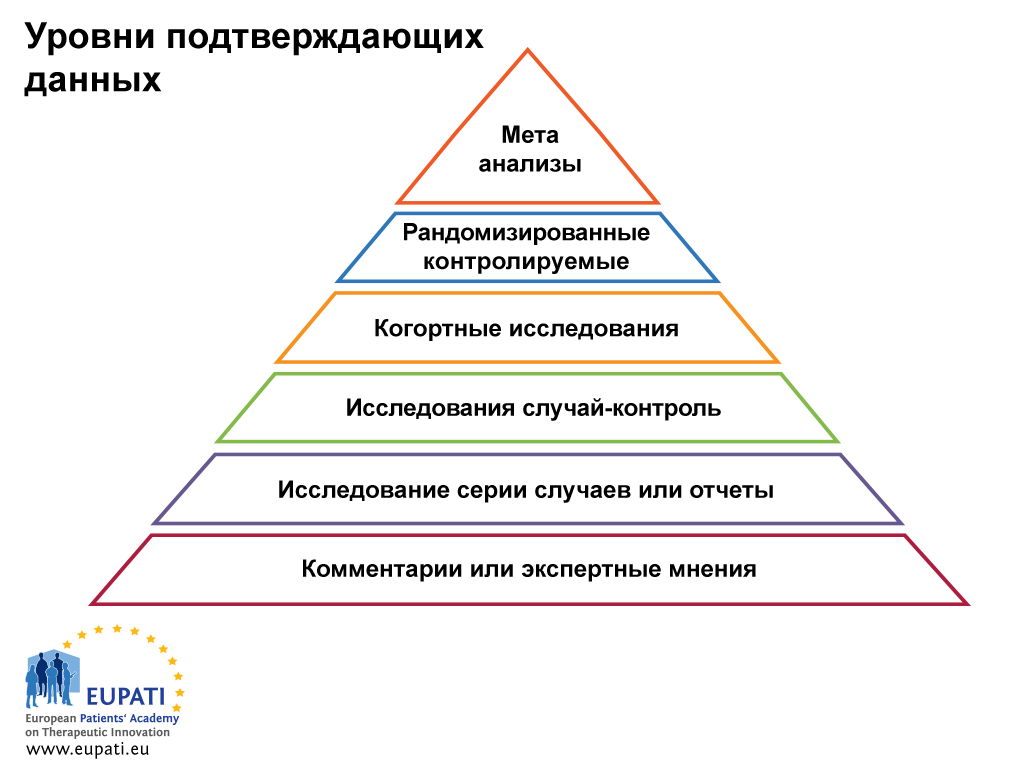
Планирование исследований в медицинской сфере называют дизайном исследования — набор методов и процедур, используемых для сбора и анализа данных по переменным, указанным в конкретном вопросе исследования. Дизайн исследования, созданный для ответа на конкретный вопрос, зависит от задач исследования и доступности ресурсов. Он разработан в зависимости от того, что должно быть сделано в исследовании, как оно будет происходить, какая информация будет собираться и почему необходимы различные части исследования. В этой статье, которая является первой частью серии, посвященной планированию или дизайну исследований, мы сфокусируемся на общих понятиях и основных терминах.



Похожие статьи
- В каком возрасте можно вязать шпица - Специальная оценка условий труда Российская газета
- Всё о химическом пилинге лица в домашних условиях - Пилинг лица лимоном - очень эффективен для очище
- Дизайн спальни с двумя окнами - Ремонт балкона и лоджии: дизайн, обустройство, интерьер, фото
- Зубные пасты с обезболивающим эффектом - Зубная паста Википедия