Почему теплоемкость газа зависит от условий процессов

Особенности теплоемкости газа и формула молярных теплоемкостей
Вспомним еще раз: для того, чтобы что-нибудь заставить совершать работу, это что-то надо заставить двигаться. Газ в этом смысле штука весьма удобная: если его нагреть, — он расширяется. Тогда, сжигая топливо, мы будем получать на выходе некую полезную работу.
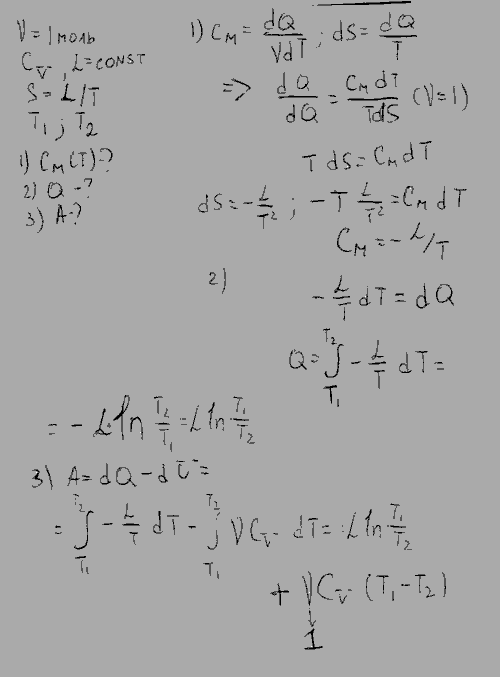

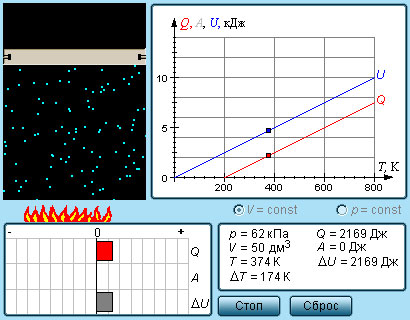
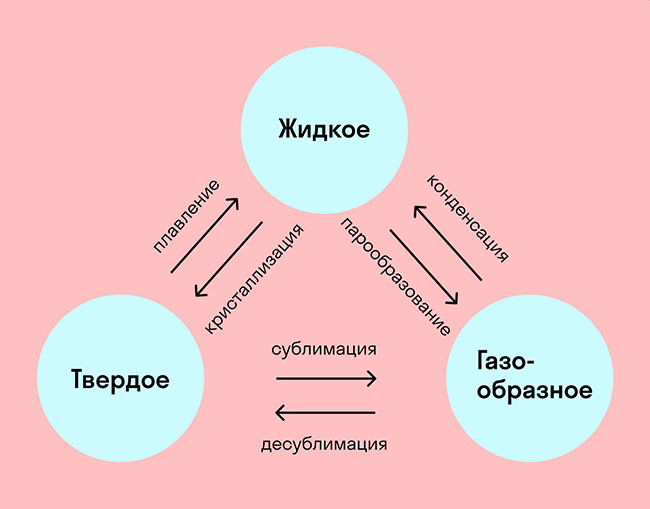

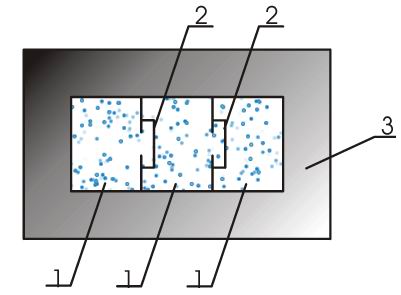








Из экспериментальных опытов известно, что сообщение разным телам одинакового количества теплоты приводит к нагреванию их до различной разности температур. Тогда необходимо ввести новую характеристику, называемую теплоёмкостью. Теплоёмкостью какого-либо тела называется величина, равная количеству теплоты, которое необходимо сообщить телу, чтобы повысить его температуру на 1 кельвин:.


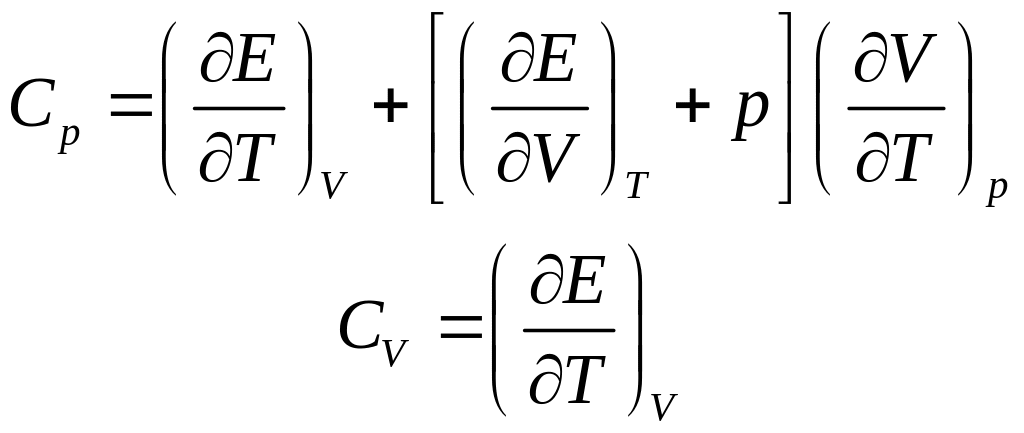


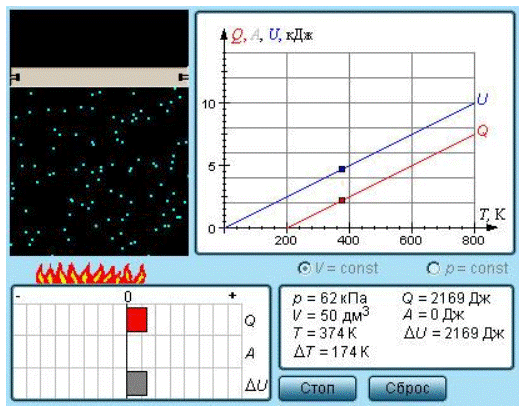
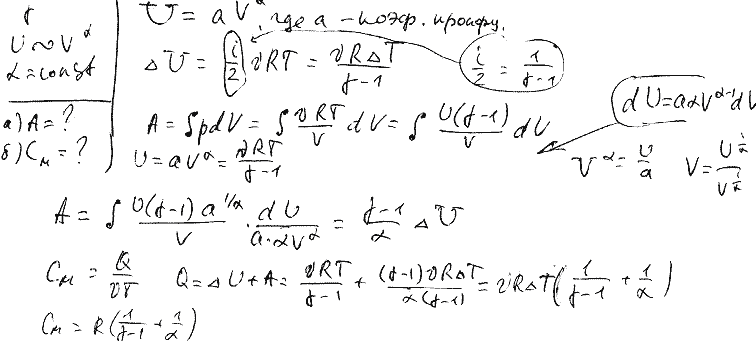



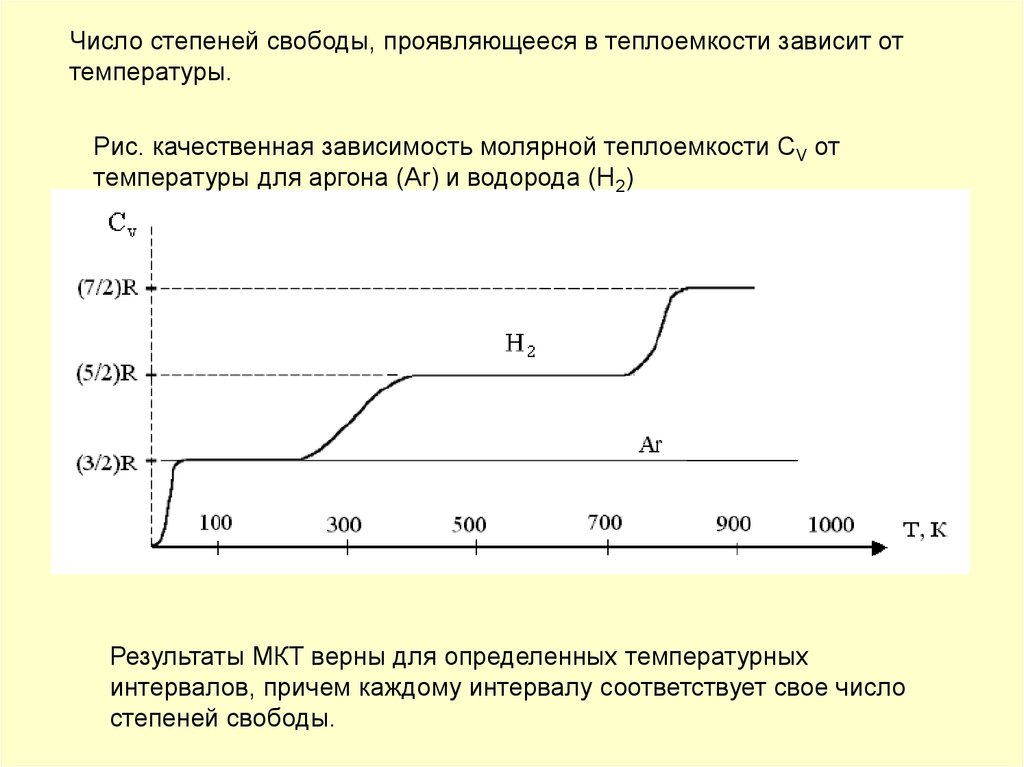
Для реальных газов теплоемкости c V и с P зависят от давления и температуры газа. Это обусловлено наличием сил межмолекулярного взаимодействия, изменением взаимного положения атомов в молекулах молекулы двух и многоатомных газов не жесткие, присутствует колебательное движение атомов в молекуле и неравномерным распределением внутренней энергии по степеням свободы в зависимости от изменения температуры и давления газа. Зависимость теплоемкости газов от давления в большей степени проявляется в состоянии газов, близком к области насыщения, об этом будет сказано в разделе "Реальные газы и пары". Для газов, состояние которых далеко от области насыщения, зависимость теплоемкости от давления незначительна и при практических расчетах ею пренебрегают. Зависимость от температуры очень существенна, ей пренебрегать при точных расчетах нельзя. Аналитическое выражение этой зависимости весьма сложное и требует нахождения целого ряда экспериментальных констант для каждого газа.




Похожие статьи
- Как сделать шоколадное обёртывание в домашних условиях - Обертывания для похудения против целлюлита
- Кухня с коробом для вентиляции дизайн - Установка газового котла на кухне требования и
- Детская мебель в домашних условиях с фото чертежи
- Красота для дома в саду - Красота Для дома в интернет-магазине модной дизайнерской и